Das Periodensystem der Elemente
Kritische Betrachtung der herkömmlichen wissenschaftlichen Einteilung
Die Einteilung des Periodensystems erfolgt nach der steigenden Elektronenzahl der Elemente und nach ihrer chemischen Ähnlichkeit. Abb.1 zeigt in der obersten Zeile die alte Einteilung, in Zeile zwei den IUPAC-Vorschlag seit 1985 und in Zeile drei die vom Chemical Abstracts Service bis 1986 verwendete Gruppenbezeichnung.
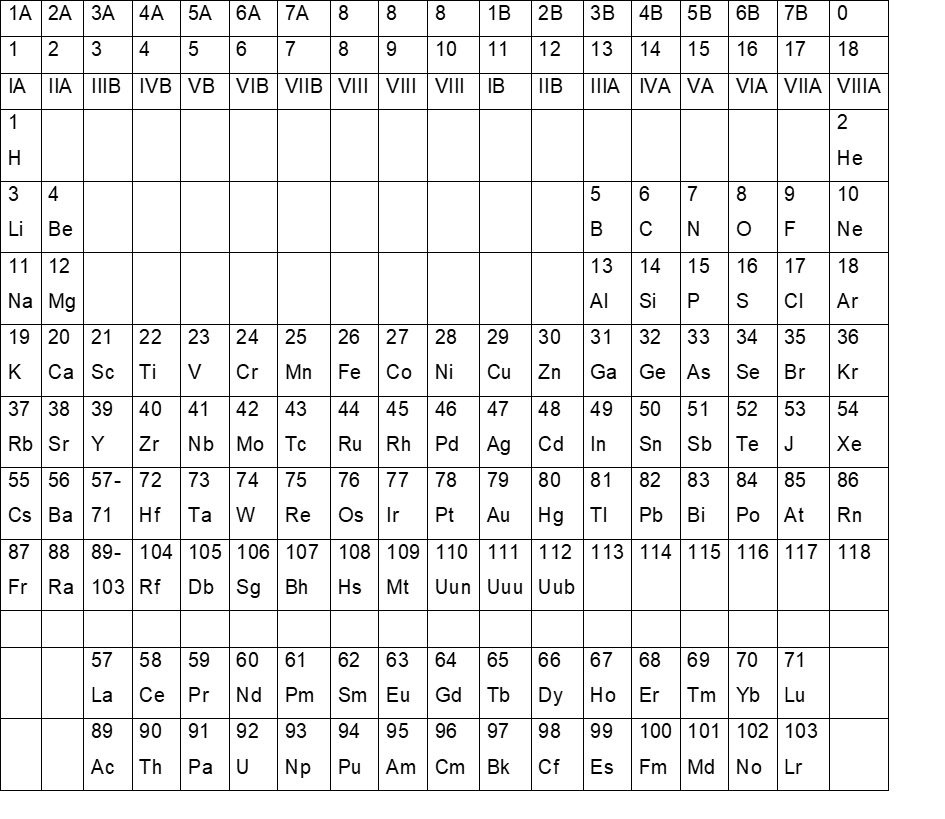
Abb. 1: Das Periodensystem der Elemente nach FLUCK und HEUMANN unter Berücksichtigung der IUPAC-Empfehlungen bis 1998
Nach dem IUPAC-Vorschlag gibt es insgesamt 18 Gruppen, nach den beiden anderen acht in A und B unterteilte, wobei die Elemente 26 bis 28, 44 bis 46 und 76 bis 78 in der Gruppe VIII oder 8 zusammengefasst sind. Allen Einteilungen ist gemeinsam, dass nach Element 57 und 89 zwei Gruppen – einmal die Lanthaniden (Elemente 57 bis 71) und einmal die Actiniden (Elemente 89 bis 103) – quasi ausgelagert werden, da sie von der herrschenden Elektronentheorie – an dieser Stelle werden die f-Elektronenniveaus besetzt – nicht ins System passen. So folgt im herkömmlichen Schema auf das Kästchen für das Element 56 im nächsten Kästchen die gesamte Lanthanidengruppe mit insgesamt 15 Elementen, bevor es mit Element 72 wieder normal weitergeht. Gleiches geschieht nach Element 88. Im 89sten Kästchen befindet sich die gesamte Actinidengruppe. Danach folgt Element 104 (siehe Abb.1).
Nach dem Standardmodell ist das niedrigste Energieniveau das s-Niveau (s-Schale) mit Platz für zwei Elektronen. Danach folgt die nächste Schale mit acht Elektronen, untergliedert in zwei s- und sechs p-Elektronen. Entscheidend ist die Zahl acht. Sie führt zur so genannten Oktettregel: Ein chemisches Element oder eine Verbindung zweier Elemente ist besonders stabil, wenn sie acht Außenelektronen besitzt wie die Edelgase Neon, Argon, Krypton, Xenon und Radon. Da die Schale, wo sich die Außenelektronen dieser Gase befinden, voll besetzt ist, sind sie dermaßen reaktionsträge, dass sie kaum chemische Verbindungen mit anderen Elementen eingehen. Das hat für diese Elektronenanordnung zu der Namensgebung „Edelgaskonfiguration“ geführt.
Die chemische Verbindung Wasser – H2O – erreicht ihre Edelgaskonfiguration dadurch, dass zu den sechs Außenelektronen des Sauerstoffatoms die beiden Elektronen der beiden Wasserstoffatome hinzutreten, so dass quasi ein Schalenabschluss mit acht Außenelektronen erreicht wird. Die p-Schale des Sauerstoffatoms beinhaltet 2 s- und 4 p-Elektronen. Zur Edelgas-Konfiguration fehlen noch 2 p-Elektronen. Die beiden Wasserstoffatome stellen je ein s-Elektron. Letztere dienen zur Auffüllung der p-Schale des Sauerstoffatoms. Die Sache hat nur einen Schönheitsfehler: Aus den s-Elektronen der beiden Wasserstoffatome müssten nun p-Elektronen werden, da ja dem Sauerstoffatom 2 p-Elektronen fehlen. Die Wissenschaftler haben deshalb einen Kniff ersonnen. In der Valence-Bond-Theorie können Elektronen energetisch angehoben werden – das nennt man „Promotion“ – und mit den Elektronen der nächst höheren Schale so genannte Hybrid-Orbitale bilden.
Nach der herrschenden Theorie müssten die beiden bindenden Elektronenpaare des Sauerstoffatoms und der beiden Wasserstoffatome den so genannten Tetraederwinkel von 109,5 Grad bilden (sp3-Hybridorbital). Tatsächlich wird in der Natur jedoch ein Bindungswinkel von 104,5 Grad beobachtet – ein nicht zu übersehender Minuspunkt für diese Theorie.
Aber das ist noch nicht alles. Allen Orbital-Theorien, sei es die Lewis-Theorie der kovalenten Bindung, die Valence-Bond-Theorie oder die Theorie von der Linearkombination von Atomorbitalen (LCAO) ist gemeinsam, dass die Atom- oder Molekül-Orbitale energetische Wahrscheinlichkeiten der Aufenthaltsorte der Elektronen darstellen. Grundlage dafür sind die Quanten-Theorie und die Schrödinger-Gleichung. Das Elektron wird darin als reine Wellenfunktion aufgefasst, die Orbitale entsprechen energetischen Zuständen der Elektronen. Die Wissenschaftler sprechen von hohen und von niedrigen Wahrscheinlichkeiten, ein Elektron an einem bestimmten Ort anzutreffen.
Dabei ist jede Anschaulichkeit verloren gegangen. Die heutige Atomwissenschaft ist nicht in der Lage, den Elektronen saubere Umlaufbahnen um ihre Atomkerne zuzuordnen. Stattdessen spricht man von Aufenthaltswahrscheinlichkeiten und Werner Heisenberg hat im vergangenen Jahrhundert sogar eine „Unschärferelation“ formuliert, nach der es nicht möglich sein soll, exakt zu bestimmen, wann ein bestimmtes Teilchen sich genau an einem bestimmten Ort aufhalten wird. Kennt man den genauen Ort, kann man nicht die genaue Zeit ermitteln, an dem das Teilchen sich an diesem Ort aufhalten wird, die Zeit ist quasi „verschmiert“. Umgekehrt ist der Ort „verschmiert“, wenn man die genaue Zeit kennt.
In meiner Sicht dienen die beiden Wasserstoffelektronen des Wassermoleküls in der herrschenden Theorie nur dazu, die Zahl acht zu erreichen und somit die „Edelgaskonfiguration“. Die Theorie basiert auf der Zahl acht und die Oktettregel bildet die Grundlage für die Einteilung der chemischen Elemente in das Periodensystem. Daraus entstanden auch die acht verschiedenen Gruppen, die dann weiter in Haupt- und Nebengruppen unterteilt wurden.
Die resultierende Frage lautet: Gibt es noch andere Möglichkeiten der Einteilung der Elektronen, die ebenfalls auf einem „Achterprinzip“ beruhen, denn dieses hat sich ja in der Praxis bewährt? Wenn ja, kann man mit dem neuen Modell den Elektronen nachvollziehbare Bahnen zuweisen, so dass der Aufbau der Materie wie in einem Baukasten anschaulich und nachvollziehbar wird?
Bei der herkömmliche Einteilung (siehe Abb.1) finden wir in den ersten zwei senkrechten Spalten mit Ausnahme des Heliums die Elemente, die zuerst mit den beiden s-Elektronen der nächst höheren Schale besetzt werden. In der zweiten und dritten waagerechten Elementen-Zeile stoßen wir auf eine je zehn Elemente breite Lücke, bevor die Elemente fünf bis zehn zusammen mit den Elementen drei und vier und die Elemente 13 bis 18 zusammen mit Nummer elf und zwölf eine Elementanzahl von je acht (zweite und dritte waagerechte Element-Zeile) ergeben. Bei den Elementen fünf bis zehn und 13 bis 18 werden die L- und die M-Schale mit je sechs p-Elektronen besetzt. Von der vierten bis zur siebten waagerechten Element-Zeile wird die Lücke mit je zehn d-Elektronen der N-, O-, P- und Q-Schale aufgefüllt. Die f-Elektronen der sechsten und siebten waagerechten Element-Zeile (P- und Q-Schale der Lanthaniden und der Actiniden) haben dann nicht mehr ins System hineingepasst, so dass diese ausgelagert werden mussten und zwei eigene Rubriken erhielten.
Bei den Lanthaniden handelt es sich um insgesamt 15 Elemente, beginnend mit Nummer 57, dem Lanthan. Davon leitet sich die Bezeichnung der ganzen Gruppe ab, die bis Element 71 Lutetium reicht. Hier werden die 14 f-Elektronen der vierten Schale eingebaut. Bei genauer Betrachtung sieht man jetzt, dass es nicht 14 sondern 15 Elemente sind. Dementsprechend handelt es sich hier nicht nur um 14 f-Elektronen, sondern zusätzlich muss noch ein d-Elektron in das System integriert werden. Das bisherige konventionelle Einteilungsschema weist hier eine Asymmetrie auf, die anfangs gar nicht so recht zu Tage trat. Erst bei genauer Analyse zeigt sich, dass das bisher durchgängige Schema an dieser Stelle durchbrochen wird. Gleiches gilt auch für die ebenfalls 15 Elemente umfassende Gruppe der Actiniden.
Die beiden waagerechten Element-Zeilen zwei und drei passen mit je acht Elementen gut ins Achtersystem hinein und wurden als die acht Hauptgruppen (senkrechte Spalten) des Periodensystems bezeichnet. Die ab der vierten waagerechten Elementzeile ausgefüllte Zehnerlücke aber lässt sich nicht mehr ohne weiteres integrieren. Als Notlösung hat man sie – wiederum die senkrechten Spalten – Nebengruppe eins bis acht genannt, wobei die Positionen acht, neun und zehn als achte Nebengruppe bezeichnet wurden, was in meinen Augen Unsinn ist. Gruppen, die in dieser Frage offensichtlich ähnlich empfanden wie ich, sind dieser Schwierigkeit aus dem Weg gegangen, indem sie alle senkrechten Spalten einfach von eins bis 18 durchnummeriert haben. So entstanden die verschiedenen Einteilungen.
Das herkömmliche Elektronenmodell weist noch eine weitere Schwäche auf. Die Elektronendichte wird in dieser Theorie von innen nach außen immer größer. Je weiter man vom Kern weg kommt, desto mehr Elektronen gibt es. In der innersten Schale sind es lediglich die zwei s-Elektronen, danach kommen die zwei s- und sechs p-Elektronen des zweiten Orbitals u.s.w. Betrachtet man Moleküle allerdings mit Hilfe der Röntgenbeugungstechnik, wie es der schottische Chemiker John Monteath Robertson (1901-1990) schon vor über sechzig Jahren getan hat, zeigt sich genau die umgekehrte Situation: die Elektronendichte nimmt zum Kern hin bei allen Atomen zu1. Das wäre eine Bedingung, die ein neues Modell natürlich erfüllen sollte.
Auch die weiteren angesprochenen Kritikpunkte wie Zusammenfassung dreier senkrechter Spalten in eine achte Nebengruppe, Auslagerung von zwei mal 15 Elementen (Lanthaniden, Actiniden) und Bindungswinkel des Wassers von 104,5 Grad sollten in einem neuen Modell widerspruchsfrei erklärt werden können.
Neueinteilung des Periodensystems
Mein neues Modell arbeitet nach dem Baukastenprinzip und jedem Teilchen wird zu jeder beliebigen Zeit ein definierter Ort zugewiesen, so dass die Heisenbergsche Unschärferelation entbehrlich wird. Es kommt auch ohne theoretische Konstrukte wie Hybridorbitale und Aufenthaltswahrscheinlichkeiten aus.
Die Daten, mit deren Hilfe die Erstellung der neuen Einteilung möglich wurde, stammen aus der Entschlüsselung des mathematischen Codes der Cheopspyramide und des Pyramidenfelds von Gizeh in Ägypten und aus den geometrischen Figuren von Nazca/Palpa in Peru.
Abb.2 zeigt in den Bergen von Palpa nahe der Ebene von Nazca ein von Erich von Däniken aus dem Flugzeug aufgenommenes Muster von Punkten und Strichen. Nach EvD besteht es aus 36 Quer- und 15 Längslinien2. Da sich aus einer in der Nähe vorgefundenen geometrischen Großfigur bereits der Aufbau der Atomkerne ableiten lies3, liegt es nahe, in dieser Figur ebenfalls Daten über die Atome als Grundbausteine der Materie zu vermuten. Es handelt sich um die Gesamtdarstellung des Periodensystems der Elemente in Form von 14 Zeilen und 2×18 Spalten. Innerhalb einer Zeile gibt es Platz für je 18 Elemente, innerhalb einer Spalte für 14 Elemente, wobei nicht jeder Platz mit einem Element belegt sein muss. Es gibt auch Lücken.
Bei genauer Betrachtung des „Schachbretts“ in Abb.2 erkennt man eine Trennung in 2 Hälften, also zwei mal 18 Spalten. Damit kommt zum Ausdruck, dass unsere Materie, die chemischen Elemente, in zwei Formen vorkommt, Materie und Antimaterie. Da wir uns zunächst nur für die Materie interessieren, muss nun die Neueinteilung der Elemente in eine Matrize aus 18 Spalten und 14 Zeilen erfolgen.
In die mittleren beiden Spalten 9 und 10 werden gemäß Abb.3 die Elemente Wasserstoff (1) und Helium (2), Kalium (19) und Calcium (20), Rubidium (37) und Strontium (38), Caesium (55) und Barium (56), Francium (87) und Radium (88) geschrieben, wobei jede zweite Zeile frei bleibt. Die Zeilen neun und 13 sind ebenfalls nicht belegt (siehe Abb.3).

- Abb.2: Das Schachbrett in den Bergen von Palpa
- Quelle: Erich von Däniken, Zeichen für die Ewigkeit, Seiten 174-175
In die Spalten eins bis acht und elf bis 18 werden die restlichen chemischen Elemente in ansteigender Reihenfolge gesetzt, wobei die Achtergruppen, die Edelgase enthalten, nach rechts, die Achtergruppen ohne Edelgase nach links geschrieben werden (siehe Abb.3).

Abb.3: Einteilung der chemischen Elemente
Im Gegensatz zur bisherigen Einteilung findet sich Element Helium (2) nicht bei den Edelgasen, sondern direkt neben Wasserstoff (1). Das hat seinen Grund darin, dass die Elemente der Spalten neun und zehn im Bereich ihrer Bindungselektronen eine andere Elektronenverteilung besitzen als die restlichen Elemente. Aus demselben Grund stehen die Elemente Lithium (3) und Beryllium (4) sowie Natrium (11) und Magnesium (12) nicht in den Spalten neun und zehn sondern in den Spalten elf und zwölf.
Element 118 Oganesson ist als Edelgas zu erwarten, da es in der Reihe Xenon (54) +32 = Radon (86) + 32 = 118 liegt. Das kann aber mangels Daten nicht verifiziert werden. Von Element 110 kann nicht prognostiziert werden, ob es ein Edelgas ist oder nicht. Da am Anfang in Zeile eins und zwei unserer Einteilung bereits mit Neon und Argon zwei Edelgase stehen, wäre es aus Symmetriegründen aber immerhin möglich.
Bei diesem Belegungsschema bleibt das Wesentliche der bisherigen Einteilung nach den chemischen Eigenschaften erhalten. Sowohl die Lanthaniden (57 bis 71) als auch die Actiniden (89 bis 103) stehen in gleicher Weise im linken Teil untereinander. Nach den Elementen 71 und 103 treten zwingend je vier Lücken auf, da Hafnium (72) und Rutherfordium (104) die jeweils zweiten Elemente ihrer Gruppe sind. Außerdem gibt es an dieser Stelle des PSE keine Elemente, die in die Zweiergruppen hineingehören würden.
Wenn die vorgenommene Einteilung der chemischen Elemente in dieser Weise korrekt sein soll, sollte es in der Natur einen Beweis dafür geben. Dazu soll ein Blick auf die erste Ionisierungsenergie I1 im Periodensystem geworfen werden (siehe Abb.4). I1 gibt vor, wieviel Energie in eV (Elektronenvolt) aufgewendet werden muss, um ein einziges Elektron aus einem Element herauszulösen, so dass ein positiv geladenes Ion entsteht. Man erkennt eine Periodizität. Bei den Minima finden sich die Alkalimetalle, bei den Maxima die Edelgase. Prima vista scheint dies die bisher geltende Einteilung zu bestätigen.
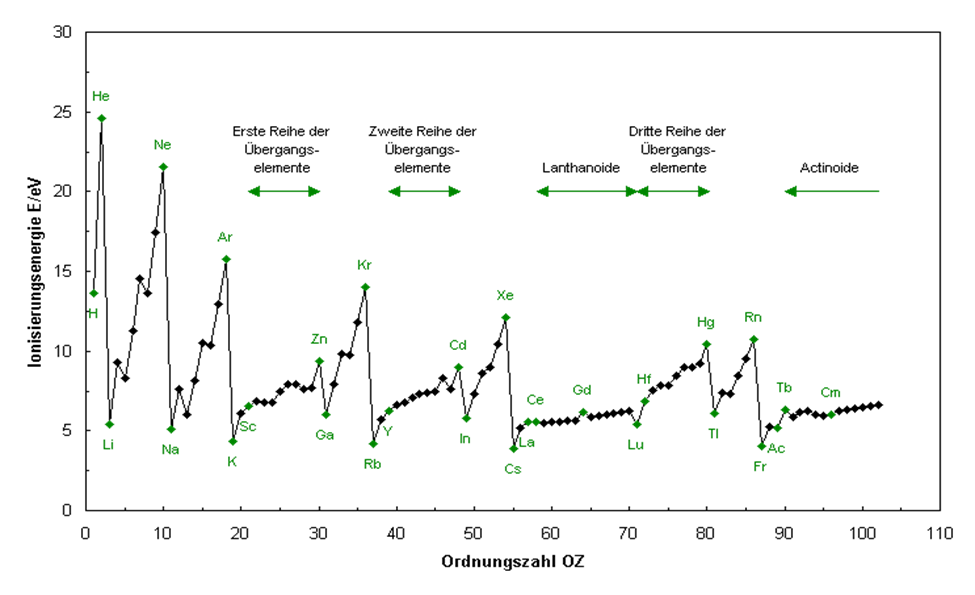
- Abb.4: Ionisierungsenergie I1 in Abhängigkeit von der Ordnungszahl
- (Quelle: chemgapedia)
Es soll aber eine genauere Analyse erfolgen. Die ersten beiden Elemente Wasserstoff (1) und Helium (2) entsprechen gemäß der neuen Einteilung den Elementen Kalium (19) und Calcium (20), Rubidium (37) und Strontium (38), Caesium (55) und Barium (56), Francium (87) und Radium (88).
Bis zum Maximum bei Neon (10) befinden sich ab Lithium (3) genau die acht Elemente der ersten rechten Achterserie (siehe Abb.3). Bis zum nächsten Maximum bei Argon (18) reichen ab Natrium (11) die Elemente der zweiten rechten Achterserie (siehe Abb.3).
In der alten Einteilung des PSE stehen sowohl Lithium und Beryllium als auch Natrium und Magnesium in den ersten beiden Spalten. Die Minima bei I1 scheinen das zu bestätigen. Zählt man dann aber weiter bis Neon und Argon, verbleiben nur noch je sechs Elemente (p-Elektronen der L- und M-Schale im Standardmodell). Das sind keine Achtergruppen mehr. Im neuen Schema zieht sich das System der Zweier- und Achtergruppen jedoch vom Anfang bis zum Schluss ausnahmslos durch.
Die Elemente Kalium (19) und Calcium (20) stehen unter Wasserstoff (1) und Helium (2) und zeigen dementsprechend einen Anstieg von I1 (siehe Abb.4: Kalium ist grün dargestellt, Calcium als nächstes Element schwarz, der nächste grüne Punkt ist Scandium als Nr.21).
Die Elemente Scandium (21) bis Nickel (28) sind bei der neuen Einteilung erstmals nach links geschrieben. Folgerichtig tritt jetzt bei I1 ein anderes Verhalten auf. Die Ionisierungsenergien weisen keinen solchen sprunghaften Verlauf auf wie bisher, sie steigen nur langsam an. Ab dem Element Kupfer (29) zeigt dann die Kurve wieder den bisherigen sprunghaften Verlauf: Anstieg 29-30, Abfall 30-31, Anstieg 31-33, fast gleiche Höhe 33-34, Anstieg zum Maximum 34-36 (Krypton). Die Achterserie Kupfer (29) bis Krypton (36) ist dementsprechend auch wieder nach rechts geschrieben.
Es folgt wieder der steile Abfall zu Rubidium (37). Rubidium und Strontium (38) stehen als nächste Zweiergruppe in der Spalte von Wasserstoff und Helium und zeigen dementsprechend auch den zu erwartenden Anstieg von I1 (siehe Abb.4: Rubidium ist grün dargestellt, Strontium als nächstes Element schwarz, der nächste grüne Punkt ist Yttrium als Nr.39).
Die nächste Achterserie Yttrium (39) bis Palladium (46) steht auf der linken Seite des Belegungsschemas und folgerichtig ergibt sich wieder ein langsamer Anstieg von I1. Die Serie Silber (47) bis zum Maximum bei Xenon (54) steht rechts, dementsprechend findet sich der analoge sprunghafte Kurvenverlauf: Anstieg 47-48 (siehe Abb.4: Cd, grün, Nr.48), Abfall 48-49, Anstieg 49-51, geringer Anstieg 51-52, Anstieg zum Maximum 52-54.
Es folgen mit Caesium (55) und Barium (56) zwei Elemente in der Spalte von Wasserstoff und Helium, Abb. 4 zeigt folgerichtig wieder einen Anstieg von I1 (siehe Abb.4: Caesium ist grün dargestellt, der nächste schwarze Punkt ist Barium, dann folgen als nächste grüne Punkte Lanthan als Nr.57 und Cer als Nr.58).
Weiter geht es mit drei nach links geschriebenen Achterserien. Die erste reicht von Lanthan (57) bis Gadolinium (64). Die Kurve von I1 verläuft erwartungsgemäß flach mit einem höchsten Wert bei Gadolinium (64) (Gd, grün in Abb.4) als letztem Element der Achtergruppe. Das erste Element der nächsten Serie Terbium (65) weist jetzt einen etwas geringeren I1-Wert auf. Der weitere Kurvenverlauf ist wiederum flach mit einem Minimum bei Lutetium (71), dem Ende der Lanthaniden. An dieser Stelle tritt im neuen Belegungsschema die erste Lücke auf. Es handelt sich um eine Siebenerserie (65 – 71). Die nächste Gruppe besteht ebenfalls aus sieben Elementen: Hafnium (72) bis Platin (78). Hier fehlt das erste Element der Gruppe. Als Ausdruck dessen (Lücke nach Lutetium und vor Hafnium) ergibt sich bei I1 ein deutlicher Anstieg (siehe Abb.4).
Der Kurvenverlauf von Hafnium (72) zu Platin (78) (in Abb.4 vorletzter schwarzer Punkt vor Hg) ähnelt dem von 39-46, deshalb ist diese Serie nach links geschrieben.
Die Elemente Gold (79) (in Abb.4 schwarzer Punkt vor Hg) bis Radon (86) zeigen als nach rechts geschriebene Gruppe den bekannten sprunghaften Kurvenverlauf von I1: Anstieg 79-80, Abfall 80-81, Anstieg 81-82. Wismut (83) zeigt als erstes radioaktives Element fast gleiche Höhe, dann erfolgt wieder der Anstieg zum Maximum bei Radon (86).
Es folgen die Elemente Francium (87) und Radium (88) in der Spalte von Wasserstoff und Helium, dementsprechend findet sich wieder ein Anstieg von I1 (siehe Abb.4: Francium ist grün dargestellt, der nächste schwarze Punkt ist Radium, dann folgt grün Actinium als Nr.89).
Die nächsten zwei Achtergruppen sind korrespondierend zu den Lanthaniden nach links geschrieben. Es handelt sich um die Actiniden (89 – 103). Es zeigt sich wieder der zu erwartende flache Kurvenverlauf. Auch die entsprechenden Lücken treten hier wieder auf: Lücke nach Element 103 und vor Element 104.
Die Ionisierungsenergien sind in Abb.4 bis zur Elementzahl 102 dargestellt. Neuere Daten über die folgenden Elemente 103 – 118 habe ich aus der Quelle Internetchemie herausgezogen (siehe Abb.5). Wie bei Lutetium als letztem Element der Actiniden (57 – 71) tritt auch bei Lawrencium als letztem Element der Actiniden (89 – 103) ein Minimum bei I1 auf und ist im Kurvenverlauf deutlich sichtbar.
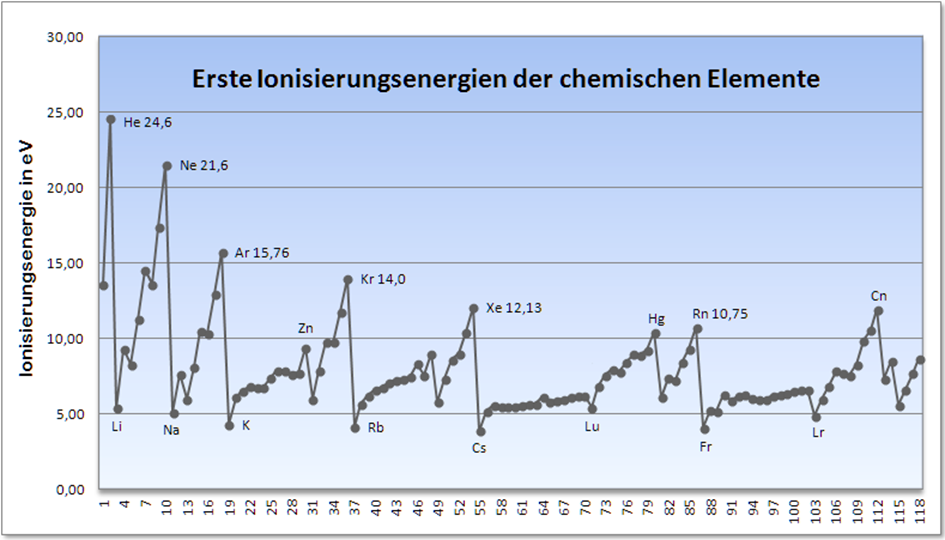
Abb.5: Ionisierungsenergie I1, Elemente 1 – 118, Quelle: Internetchemie
Die folgende Achtergruppe der Elemente 104 bis 110 ist nach rechts geschrieben, obwohl die auf die Lanthaniden folgende Gruppe Hafnium (72) bis Platin (78) links steht. Das geschieht deshalb, weil Platzgründe auf den noch zu besprechenden Elektronenringen dies erzwingen. Folgerichtig findet sich bei I1 der Elemente 104 – 110 wieder der sprunghafte Kurvenverlauf, ebenso wie bei den nach rechts geschriebenen Elemente 111 – 118.
Die vorgenommene Neueinteilung des Periodensystems der Elemente hat sich ausnahmslos im Bereich der Ionisierungsenergie I1 bewährt. Sogar die prognostizierten Lücken zwischen den Elementen 71 und 72 sind im Kurvenverlauf abgebildet, die Lücken zwischen den Elementen 103 und 104 lassen sich auch darstellen, wenn auch nicht so deutlich wie bei den Elementen 71 und 72..
Gegenüber der bisher nach dem Standardmodell geltenden Einteilung des PSE ist das Element Helium von den Edelgasen weggerückt und hat seinen Platz direkt neben dem Element Wasserstoff gefunden. Dagegen sind die Elemente Lithium und Beryllium sowie Natrium und Magnesium aus den beiden ersten Spalten des PSE in die entsprechenden Achtergruppen hineingerückt.
Sowohl die Lanthaniden (Elemente 57 – 71) als auch die Actiniden (Elemente 89 – 103) sind in die Achtergruppen integriert worden, besitzen aber statt 16 Elementen nur 15, wodurch nicht belegte Plätze entstanden sind.
Wir haben jetzt also eine Einteilung in Zweiergruppen und Achtergruppen, die auf der Schachbrettfigur aus den Bergen von Palpa fußt und zu Hundert Prozent von der Darstellung der Ionisierungsenergie I1 abgedeckt wird.
Aber warum treten hier die Zweier- und die Achtergruppen auf?
Die Antwort ist zugleich einfach und doch überraschend: Es handelt sich um zwei verschiedene Elektronenanordnungen. An dieser Stelle kommt der bei der Berechnung der Masse der Elementarteilchen auftauchende und noch zu besprechende Wert 1/7 me (e steht hier für Elektronenmasse) ins Spiel.
Weiter erhebt sich die Frage, warum die Achtergruppen einmal nach rechts und dann nach links geschrieben werden. Das hängt damit zusammen, dass die Elektronen sich auf einem inneren und einem äußeren Elektronenring aufhalten, korrespondierend zum inneren und äußeren Neutronenkreis aus meinem Neuen Modell des Atomkerns3. Je nachdem ob ein Elektron innen oder außen sitzt, muss innerhalb der Achtergruppen zu seiner Herauslösung unterschiedlich viel Energie aufgewendet werden (sprunghafter Kurvenverlauf, nach rechts geschrieben, innerer Elektronenring) oder fast gleiche Energie (flacher Kurvenverlauf, nach links geschrieben, leichter zugänglicher äußerer Elektronenring).
1 Schmidt, Avraham K.-T. und Norman-Schmidt, Sabine: Naturwissenschaftlicher Nachweis für die Bedeutung von Schwingungen und elektromagnetischen Feldern in DVR Aussendung Nr. 47 S. 41
2 Erich von Däniken: Zeichen für die Ewigkeit, Bertelsmann Verlag GmbH, München 1997, S.172
3 Dr. Frank Rothe: Neues Modell des Atomkerns
